光遗传学会不会获诺奖?

“诺奖风向标”拉斯克奖揭晓,光遗传学领域的三位科学家获2021年的拉斯克奖基础医学研究奖 | 图源:laskerfoundation.org

导 读
北京时间9月25日零点,2021年拉斯克奖(The Lasker Awards)公布了三大奖项获奖名单。其中,基础医学研究奖由Dieter Oesterhelt、Peter Hegemann 和Karl Deisseroth获得,以表彰他们对光遗传学的贡献;来自BioNTech的Katalin Karikó和宾夕法尼亚大学的Drew Weissman获得临床医学研究奖,以表彰他们发现基于mRNA修饰的新治疗技术;医学科学特别成就奖则颁给了诺贝尔奖得主David Baltimore。
光遗传学被认为是一项注定要得诺奖的技术(相关文章:光遗传学:一项注定要得诺贝尔奖的技术)。
实际上,对于光遗传学技术作出贡献的科学家不止这三人,还有他们的合作者和其他科学家。
科学的发展常常伴随着科学家竞争,这是科学的常态。每一项科学成果的背后,故事主角们都有不同的悲喜。但无论结局如何,每一位探索在知识边缘的科学家都值得我们深深的敬意。
撰文|王承志 梁希同 林岑
责编|夏志坚 陈晓雪
● ● ●
北京时间2021年9月25日零点,有 “诺奖风向标” 之称的拉斯克奖(the Lasker Awards)公布,三位在光遗传学领域作出重要贡献的科学家获得阿尔伯特·拉斯克基础医学研究奖。
获奖理由:
发现了可以激活或沉默单个脑细胞的光敏微生物蛋白,并将其用于开发光遗传学——神经科学领域的一项革命性技术。
根据拉斯克奖官网介绍,三位获奖人的具体贡献分别是:
迪特尔·奥斯特黑尔特(Dieter Oesterhelt),发现了一种古细菌蛋白质,它可以在光照条件下将质子泵出细胞;
彼得·黑格曼(Peter Hegemann),在单细胞藻类中发现了相关的通道蛋白;
卡尔·代塞尔罗思(Karl Deisseroth),利用这些分子创建了光触发系统,这些系统可以在活的、自由移动的动物身上使用,以理解在迷宫一般的脑回路中特定类别乃至一类神经元的作用。
大脑是人最复杂的器官,人的感觉、记忆、思考、运动等诸多生理活动,以及各种神经系统疾病都与神经元的功能息息相关。多年以来,理解各种神经元的具体功能一直是神经生物学的中心研究领域。
特异性地控制神经元活动对神经生物学家具有无法抵挡的吸引力。如果能特异性地激活一类神经元,那么就可以通过观察激活后的生理现象来推测其功能。同理,如果能特异性地抑制一类神经元,则可以推测这类神经元对哪些生理活动是必须的。
神经生物学家们尝试过各种方法来达到这个目标。比如,用微电极来刺激神经元,或者使用化学物质来模拟或者拮抗神经递质。但这些方法都有难以克服的缺陷:微电极控制的精度不够,比如不能特异性地控制一类神经元;化学物质控制神经元的速度难以控制,很难在毫秒级别进行操作。
紫色的膜与光传感器
1969 年,29岁的青年化学家迪特尔·奥斯特黑尔特(Dieter Oesterhelt,1940年-)从德国慕尼黑大学学术休假,来到了美国加州大学旧金山分校电子显微镜专家沃尔瑟·斯托克尼乌斯(Walther Stoeckenius,1921年7月3日-2013年8月12日)的实验室。
当时,斯托克尼乌斯正在研究一种可以在高盐环境中生存的古细菌的细胞膜,这种微生物现在被称作盐生盐杆菌(Halobacterium salinurum)。在这次合作中,奥斯特黑尔特证实盐生盐杆菌的细胞膜中紫色的组分含有视黄醛。随后,他和斯托克尼乌斯确定了古细菌中的一种蛋白质,并将其命名为细菌视紫红质(bacteriorhodopsin)。1971 年,他们提出细菌视紫红质起到了光传感器或光感受器的作用。

迪特尔·奥斯特黑尔特 | 图源:biochem.mpg
回到德国后,奥斯特黑尔特和斯托克尼乌斯继续合作这一研究。奥斯特黑尔特发现,细菌视紫红质可以将质子泵出细胞。这个神奇蛋白质,像是一个微型光能发电机,能吸收光子的能量,用这些能量把质子泵到细胞的外面,从而进一步转化为细菌所需的能量。
后来,科学家们发现了另外一种含视黄醛的光激活泵——卤化视紫红质(halorhodpsin),可以将氯离子输送到细胞中。这两种物质的发现和对其生物物理、结构和遗传学的研究,为光遗传学的发展提供了基础性的见解。
来自微生物的光敏蛋白
20世纪80年代,彼得·黑格曼在位于慕尼黑的马克思·普朗克生物化学研究所攻读博士学位。他的导师正是发现细菌视紫红质的迪特尔·奥斯特黑尔特。
黑格曼的博士论文,研究的是来自另一种细菌的视紫红质——卤化视紫红质(halorhodopsin)。
卤化视紫红质存在于一种耐盐古细菌中,其利用光能将其生活的高盐度环境中的氯离子排出体外。黑格曼首先通过生物化学技术分离提纯了这一蛋白。

彼得·黑格曼 | 图源:project-stardust.eu
此时,刚刚在法兰克福的马克思·普朗克生物物理研究所建立自己实验室的恩斯特·班贝格(Ernst Bamberg)参与了进来,他通过构建体外系统来研究黑格曼所提纯出的halorhodopsin的电化学特性。
1984年获得博士学位后,黑格曼来到美国雪城大学的肯·福斯特(Kenneth Foster)的实验室从事博士后研究。
福斯特研究的是另一种对光敏感的微生物:单细胞绿藻。这些单细胞的藻类具有趋光性,能够挥舞鞭毛向着有光的方向游去(它们需要光进行光合作用)。福斯特认为,单细胞绿藻也可能使用某种视紫红质作为它们的眼睛,从而得知光亮的方向,并且能驱动鞭毛游往有光的地方。
莱茵衣藻 Chlamydomonas reinhardtii
1986年,黑格曼回到普朗克生物化学研究所建立起自己的实验室,开始潜心研究莱茵衣藻(Chlamydomonas reinhardtii,一种微小的绿藻)趋光性行为。
1991年,黑格曼发现,莱茵衣藻的光受体也是一种视紫红质,但它的工作方式与之前发现的各种视紫红质都不一样。衣藻视紫红质的光照之后会引起钙离子流入细胞中,从而引起的电流能够激发鞭毛的运动,他称之为光电流(photocurrent)。

恩斯特·班贝格(Ernst Bamberg)
人眼中的视紫红质感光之后也会产生光电流,通过神经传递到大脑之后就形成了视觉。人眼中视紫红质引起光电流需要经过细胞内一系列蛋白的信号传导,而黑格曼发现衣藻视紫红质产生光电流的速度比人眼中的视紫红质快得多。据此他大胆地推测:衣藻视紫红质本身可能就是一个可以作为电流开关的离子通道。
然而,此后的十年里,黑格曼使尽各种办法,也无法像当初分离提纯一样分离卤化视紫红质提纯出衣藻视紫红质,来验证他的猜想。
随着分子生物的发展,2001年,黑格曼和其他科学家通过测序衣藻的基因组发现了两个新的光受体基因。
为了证明它们究竟是不是苦苦追寻十余年的衣藻视紫红质,黑格曼找到了当初和合作研究卤化视紫红质电化学特性的班贝格。
此时的班贝格已经是普朗克生物物理研究所的所长。此前的1995年,班贝格就和普朗克生物物理研究所的科学家格奥尔格·纳格尔(Georg Nagel)将细菌视紫红质表达在动物细胞中,使得动物细胞在受到光照时产生光电流。

奥尔格·纳格尔(Georg Nagel)
2003年,从黑格曼那里得到光受体基因后,班贝格和纳格尔用同样的方法成功地在动物细胞中表达了衣藻视紫红质蛋白,从而发现只要有这个蛋白单独存在,就能产生光电流,使阳离子流入细胞中,造成细胞去去极化。他们的结果终于证明黑格曼的假说:衣藻视紫红质是一个能被光所打开的阳离子通道。
从前人们知道,特定的化学分子,或者电压的变化,或者机械力的变化可以开关特定的离子通道,而能被光直接控制的离子通道还是第一次被发现,于是他们把衣藻视紫红质命名为视紫红质通道蛋白(Channelrhodopsins,ChR1)。这个词由离子通道(Channel)和视紫红质(Rhodopsin)组合而成。
他们还在爪蟾的卵细胞中表达了这种蛋白,发现光照可以引起细胞的静息电位发生变化。这项开创性的工作发表在了2002年6月的 Science 上。
2003年,纳格尔和黑格曼又发现了一个新的通道蛋白——ChR2。这一次,他们不但做了更深入的机制研究,而且把ChR2首次在人的细胞(HEK)中表达。作者在文章结论中写道:“ChR2能够成为控制细胞内钙离子浓度或者细胞膜极化水平的有用工具,特别是在哺乳动物细胞中”。
ChR1和ChR2的发现,让一些神经生物学家眼前一亮——这或许就是使用光来控制神经元的理想介质。而光遗传学的大门从这里也正式开启了。
光遗传学的诞生
视紫红质通道蛋白的发现,不仅仅解释的衣藻的趋光性行为,纳格尔和班贝格的实验还证明了这个来自衣藻的光敏感通道能独自驱使动物细胞产生光电流。因此,借助这个光敏感通道,就可以通过光来遥控动物细胞,特别是神经细胞的电活动。
用光来改变神经细胞的电活动是神经科学家长久以来的梦想,光刺激有着比传统药物刺激和电刺激更高的时间和空间的精确性,并且对组织的伤害更小。
20世纪90年代,科学家开始使用光控释放神经递质来激活细胞,但这种方法的时间和空间的精确性仍然不够。
2002年,奥地利神经科学家格罗·米森伯克 (Gero Miesenböck)开始在光控中引入遗传学,尝试将果蝇眼中的视紫红质表达在哺乳动物细胞中,或者将哺乳动物的离子通道表达的果蝇的神经细胞中。使用遗传学的优势在于,可以专门针对研究者想到测试的神经细胞进行遥控,但米森伯克缺乏一种强有力的工具可以让光精确地改变神经活动。

格罗·米森伯克 (Gero Miesenböck) | 图源:cncb.ox.ac.uk
2003年在衣藻中发现的视紫红质通道蛋白正好提供了这样一个强有力的工具。
2000年,爱德华·博伊登(Edward S. Boyden,1979-)来到斯坦福大学,在钱永佑(Richard Tsien,钱永健的哥哥)和詹妮弗·雷蒙德(Jennifer Raymond)教授的指导下,研究小脑神经回路。
在钱永佑的实验室,博伊登遇到了钱永佑之前的博士生卡尔·代塞尔罗思(Karl Deisseroth,1971-)。代塞尔罗思之前在斯坦福大学学习神经生物学,并在斯坦福医院当过精神科住院医师。
有着工程背景的博伊登和医学背景的代塞尔罗思经常在一起讨论当时神经生理学的研究技术。多次的思想碰撞让两位年轻人意识到,当时的技术还有很大局限,神经生物学家需要更好的工具来控制大脑中特异的神经元,他们决定开发这样的工具。

Edward S. Boyden | 图源:mcgovern.mit.edu
他们最初设想可以使用磁场来控制神经元,在神经元中表达机械拉力敏感的离子通道,然后把微小的磁珠特异性连接到这种通道蛋白上,这样就可能通过外部磁场来控制神经元的电活动。但是,无论是找到合适的机械敏感离子通道基因还是把磁珠连接到通道蛋白上,技术难度都非常大。
后来,博伊登在阅读一篇1999年发表的论文中得到了灵感。这篇论文报道了在嗜盐碱单胞菌中发现的卤化视紫红质(halorhodopsin),能够在大脑的氯离子浓度下工作。这种视紫红质可以在受光照时激活离子通道。
博伊登意识到使用光来控制离子通道比磁场更容易实现。他写邮件给这篇论文的作者,索要了这个蛋白的基因。但后来由于博伊登忙于博士学位论文,这件事情被晾在了一边。
2003年秋天,代塞尔罗思即将独立成为PI,组建自己的实验室。他写邮件给博伊登,希望博伊登博士毕业后可以去他的实验室做博后,一起开展之前讨论的使用磁场控制神经元的项目。

卡尔·代塞尔罗思 | 图源:www.hhmi.org
从2003年10月到2004年2月,代塞尔罗思和博伊登为即将开始的磁控神经元项目阅读了大量的文献。恰在此时,纳格尔、黑格曼和班贝格及同事们在 PNAS 期刊上发表了前文提到的ChR2的论文。
博伊登阅读这篇论文时立刻意识到,ChR2拥有他们设想过的一切特性:在一个蛋白中把输入信号(光)和输出(去极化神经细胞)偶联起来。事实上,同时意识到这一ChR2这一特性可以用于光控神经细胞的,远不止博伊登一人。
博伊登写信给代塞尔罗思,希望能联系纳格尔索要ChR2的克隆。代塞尔罗思于2004年3月联系了纳格尔。那时,纳格尔已对ChR2做了一些改良,他把这些改良后的克隆寄送给了代塞尔罗思和博伊登。
博伊登当时还在钱永佑的实验室做博士课题。但从2004年7月开始,博伊登几乎把博士课题放在了一边,专心做起了ChR2在神经元中表达的项目。
2004年8月4日的凌晨1点,博伊登在钱永佑的实验室里用蓝光照射表达了ChR2的神经元,成功观察到了去极化和动作电位。早上,他发邮件给代塞尔罗思告诉了他的发现。代塞尔罗思回信:“太棒了!!!!!” 五个感叹号显示了他当时的兴奋心情。
2005年初,张锋(就是后来最早在哺乳动物细胞中使用CRISPR做基因编辑的那位,现麻省理工学院教授)来到代塞尔罗思实验室开始了研究生生涯。他改进了博伊登的表达体系,使用慢病毒在神经元中表达ChR2,大大增加了该系统的稳定性。
2005年4月19日,博伊登和代塞尔罗思把他们的发现投稿给 Science 杂志,遭拒稿,理由是没有具体的科学发现。5月5日,他们投稿到 Nature 杂志,Nature 建议把稿件转投给 Nature Neuroscience 杂志。经过一轮修改,Nature Neuroscience 接受了这篇文章。
光遗传学的其他研究者
自从黑格曼等在2003年发表了光敏通道蛋白ChR1和ChR2,很多科学家都意识到这类光控通道蛋白有极大的应用潜力。一场无形的竞争也在悄然展开。
美国底特律的韦恩州立大学华人神经科学家潘卓华是一位视觉专家,他在2000年早期即构想将光敏蛋白表达在盲人的眼内,以代替视杆细胞和视锥细胞的缺失。

潘卓华 | 图源:kresgeeye.org
2003年ChR1和ChR2论文的发表,潘卓华敏锐地觉察到这可能就是他一直在寻找的光敏蛋白。
他与萨鲁斯大学(Salus University)的 Alexander Dizhoor 教授合作,在神经节细胞中表达ChR2。Dizhoor 教授的团队设计合成了光敏通道蛋白的DNA,并添加了示踪的荧光蛋白——这与纳格尔对ChR2的改良非常类似。同时,潘卓华使用病毒在细胞中表达ChR2,这与张锋在代塞尔罗思实验室的改进也相似。
2004年7月,潘卓华将载有ChR2基因的病毒注入给小鼠,5周后他通过荧光蛋白确认了ChR2在视网膜细胞上的表达。当他打开照射灯时,插入视网膜的电极显示了明显的电活性。这显然是个了不起的实验,它第一次证明了ChR2在活体动物中的活性,证明表达视紫红质通道蛋白可以使的失明的大鼠重新感光——这有着极大的应用价值,有可能成为治愈盲人的一种方法。
2004年11月25日,潘卓华和合作者将这些发现投稿给 Nature 杂志。与代塞尔罗思的文章遭遇一样,Nature 建议将文章改投到旗下子刊 Nature Neuroscience。
不过,潘卓华的论文继续被拒。2005年初,潘卓华将文章投到Journal of Neuroscience ,再次遭拒稿。
2005年5月,潘卓华在佛罗里达参加视觉与眼科学研究协会大会时,简短报告了他的这项成果。当时他的论文还没有发表,这是该工作第一次公布于众。
最后,潘卓华的论文几经周折,直到2006年4月在 Neuron 杂志发表 。不过,这篇文章所受的
2005年,日本的 Hiromo Yawo 实验室和美国的凯斯西储大学的林恩·兰德梅赛(Lynn Landmesser)和 Stefan Herlitze 也发表了类似的结果,他们比代塞尔罗思等人等的文章晚了两三个月。
一位长期
科学的发展常常伴随着科学家竞争,这是科学的常态。每一项科学成果的背后,故事主角们都有不同的悲喜。但无论结局如何,每一位探索在知识边缘的科学家都值得我们深深的敬意。
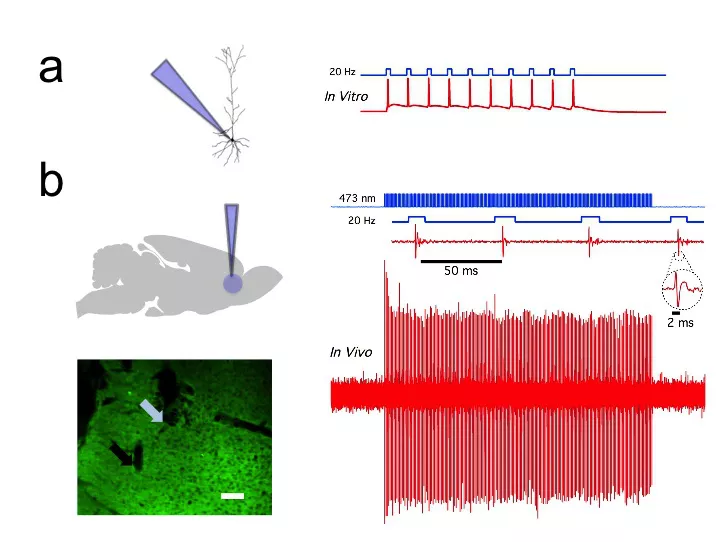
光照使表达了Channelrhodopsin的神经元放电
光遗传学的发明,几乎在一夜之间改变了神经科学研究。
从线虫到灵长类动物,人们在几乎所有实验动物中表达光敏感通道来实现远程遥控神经活动。通过在不同类型的神经细胞中表达光敏感通道,人们可以用光控制小鼠的行为,控制它们的运动,使它们产生虚拟的饥饿感或饱腹感,甚至在它们脑中用光写入或抹去特定的记忆。
光遗传学已经成为神经科学中证明因果性的关键手段。这一技术也为众多医学应用开辟了道路。科学家们希望能利用光,给盲人提供基本视力,刺激患有帕金森病的患者的深部脑,甚至影响心律,以治疗心力衰竭。
用光纤控制实验鼠的行为
作为一项彻底改革了神经科学发展的技术,光遗传学也让包括黑格曼、纳格尔、班贝格、代塞尔罗思、博伊登在内的科学家在过去几年中屡获殊荣,其中包括了2010年《科学》杂志十年最佳进展,2013年的大脑奖,2015年的生命科学突破奖、2016年度科学突破奖、2019年的拉姆福德奖金和2020年的邵逸夫奖等。
回到故事最开始的时候,科学家们只是想知道单细胞藻类微小的秘密。彼时,没有人会想到,那些努力向光游去的小绿藻,最终居然教会我们如何改写大脑活动的秘诀,推动我们向解开大脑秘密前进了一大步。
迪特尔·奥斯特黑尔特
现为德国马克斯·普朗克生物化学研究所名誉组长。他1940年11月10日出生于德国慕尼黑,1959-1963年在德国慕尼黑大学学习化学,1967年他博士毕业于慕尼黑大学,之后担任马克斯·普朗克细胞化学研究所研究助理。1969年,奥斯特黑尔特前往加州大学旧金山分校做研究,并在那里开启了对细菌视紫红质的研究。1973-1975年,他是马克斯·普朗克学会弗里德里希·米歇尔实验室的研究组长,1976-1979年在维尔茨堡大学任正教授。1980年之后,奥斯特黑尔特长期担任马克斯·普朗克生物化学研究所所长。2008年退休。
彼得·黑格曼
1954年12月11日出生于德国明斯特。1975年至1980年在明斯特大学和慕尼黑大学学习化学。1980年至1984年在马克斯·普朗克生物化学研究所 Dieter Oesterhelt 教授的指导下完成博士学位,研究细菌的光敏感离子泵。之后,在美国雪城大学的Kenneth Foster 实验室从事博士后工作,开始研究单细胞藻类的趋光行为。
1986年黑格曼回到马克斯·普朗克生物化学研究所建立微藻光受体实验室。1991年发现衣藻的光电流。2002年找到介导衣藻光电流的基因,即视紫红质通道蛋白(Channelrhodopsins)。2005年至今,在柏林洪堡大学担任生物物理学教授和系主任。
卡尔·代塞尔罗思
代塞尔罗思为美国斯坦福大学教授。他1971年出生于美国,在哈佛大学获得生物化学学士学位后,1998年在斯坦福大学获得神经学博士学位。2004年,他在斯坦福大学建立自己的实验室。
2005年,代塞尔罗思和博士后爱德华·博伊登(Edward Boyden)、学生张锋等共同发表了一篇论文,首次利用通道视紫红质在神经细胞上实现了毫秒级动作电位的控制。2006年,代塞尔罗思将这种方法命名为“光遗传学”。他们的方法很快被广泛应用于生物学各个领域,使生物学家可以用光控制各种生命活动。
主要参考资料
[1] Bamberg, Ernst, Peter Hegemann, and Dieter Oesterhelt. "The chromoprotein of halorhodopsin is the light-driven electrogenic chloride pump in Halobacterium halobium." Biochemistry 23, no. 25 (1984): 6216-6221.
[2] Harz, Hartmann, and Peter Hegemann. "Rhodopsin-regulated calcium currents in Chlamydomonas." Nature 351, no. 6326 (1991): 489-491.
[3] Nagel, Georg, Bettina Möckel, Georg Büldt, and Ernst Bamberg. "Functional expression of bacteriorhodopsin in oocytes allows direct measurement of voltage dependence of light induced H+ pumping." FEBS letters 377, no. 2 (1995): 263-266.
[4] Nagel, Georg, Doris Ollig, Markus Fuhrmann, Suneel Kateriya, Anna Maria Musti, Ernst Bamberg, and Peter Hegemann. "Channelrhodopsin-1: a light-gated proton channel in green algae." Science 296, no. 5577 (2002): 2395-2398.
[5] Boyden, Edward S., Feng Zhang, Ernst Bamberg, Georg Nagel, and Karl Deisseroth. "Millisecond-timescale, genetically targeted optical control of neural activity." Nature neuroscience 8, no. 9 (2005): 1263-1268.
[6]Zemelman, Boris V., Georgia A. Lee, Minna Ng, and Gero Miesenböck. "Selective photostimulation of genetically chARGed neurons." Neuron 33, no. 1 (2002): 15-22.
[7]Nagel, Georg, Tanjef Szellas, Wolfram Huhn, Suneel Kateriya, Nona Adeishvili, Peter Berthold, Doris Ollig, Peter Hegemann, and Ernst Bamberg. "Channelrhodopsin-2, a directly light-gated cation-selective membrane channel." Proceedings of the National Academy of Sciences 100, no. 24 (2003): 13940-13945.
[8]Boyden, Edward S. "A history of optogenetics: the development of tools for controlling brain circuits with light." F1000 biology reports 3 (2011).
[9]Bi, Anding, Jinjuan Cui, Yu-Ping Ma, Elena Olshevskaya, Mingliang Pu, Alexander M. Dizhoor, and Zhuo-Hua Pan. "Ectopic expression of a microbial-type rhodopsin restores visual responses in mice with photoreceptor degeneration." Neuron 50, no. 1 (2006): 23-33.