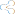中国3个新冠疫苗获批临床试验
我国3个新冠疫苗获批临床试验
两个灭活疫苗相继获批;腺病毒载体疫苗成全球首个进入二期临床试验的新冠疫苗

陈薇院士与参与疫苗二期临床试验的84岁武汉志愿者(右)。通讯员 王虎 高翔 摄
继陈薇院士团队研发的腺病毒载体疫苗获批进入临床研究后,4月12日、13日,两个新冠病毒灭活疫苗获得临床试验许可。至此,我国已有3个疫苗获批进入临床试验。
新京报讯 4月14日,国务院联防联控机制举行发布会,介绍新冠肺炎药物研发、疫苗研制进展。发布会上,科技部社会发展科技司司长吴远彬介绍,目前我国已有3个疫苗获批进入临床试验。
两天两个灭活疫苗获批进入临床试验
吴远彬介绍,4月12日,国家药监局批准中国生物武汉生物制品研究所和中国科学院武汉病毒研究所联合申请的新冠病毒灭活疫苗,进入临床试验。
4月13日,国家药监局又批准北京科兴中维生物技术有限公司研制的灭活疫苗开展临床试验。“这是连续两天对灭活疫苗进行审批开展临床试验。”吴远彬说。
中国工程院院士王军志对新批准的两个灭活疫苗进行了介绍。他表示,灭活疫苗通过理化方法灭活病毒致病性,再通过纯化工艺等制备过程制备出候选疫苗。候选疫苗接种到机体可以刺激机体的免疫反应,产生抗体,达到保护作用。“我们国家研发并已上市的疫苗中,灭活疫苗的基础还是比较好的。”
我国研发疫苗全球首个进入二期临床试验
我国首个获批进入临床研究的疫苗,是陈薇院士团队研发的腺病毒载体疫苗。
吴远彬介绍,3月底,陈薇院士的团队完成了一期临床试验受试者的接种工作,并于4月9日开始招募二期临床试验志愿者,这是全球首个启动二期临床研究的新冠疫苗品种。1月26日,陈薇率团队赴武汉一线,与北京后方科研基地同时作战,开展疫苗研发攻关。3月27日完成疫苗一期临床试验接种的108位志愿者,目前全部结束集中医学观察,健康状况良好。
灭活疫苗临床试验将很快启动
4月14日下午,在北京市新冠肺炎疫情防控工作新闻发布会上,科兴控股生物技术有限公司董事长、总裁兼首席执行官尹卫东介绍了旗下公司科兴中维疫苗研究的细节。
据尹卫东介绍,科兴中维1月28日正式启动名为“克冠行动”的新型冠状病毒疫苗研制项目。目前研究进度显示,对疫苗进行不同剂量、不同免疫程序的免疫原性、攻毒保护性等研究,结果显示疫苗在动物体内能产生良好的免疫反应。
尹卫东说,科兴中维研制的新型冠状病毒灭活疫苗系用新型冠状病毒(CZ株)接种Vero细胞,经病毒培养、收获、灭活、纯化和铝吸附制成,不添加防腐剂和生物保护剂。目前临床试验用新冠灭活疫苗已通过中检院检定,临床试验将很快启动。科兴将按照国家药监局的要求,严格遵守GCP及相关法规实施临床试验。
■ 回应
疫苗何时上市,安全性如何保障?
3个新冠病毒疫苗通过应急审批进入临床试验,应急审批速度如此之快,疫苗的安全性能否得到保障?
对此,国家药监局药品注册司副司长杨胜表示,疫苗的安全性,主要是由临床前的相关动物实验等研究来决定,其中包括急性毒性实验、重复毒性实验、免疫原性实验,甚至是动物攻毒保护试验,这些实验都要符合要求,达到规定的要求,才能够批准上临床。
审批之所以能提速,是很多研发的步骤由串联改为并联,研审联动,滚动提交研发材料,随交随审随评。在标准不降低的前提下,通过无缝衔接,大大提高了研发的效率和审评的效率。
至于疫苗何时能够正式上市,杨胜表示,疫苗临床试验通常分为三期(三个阶段)。每期的目标和意义不一样,根据研发的设计,方案不一样,需要的时间也不一样。但是有一点,必须要遵循《药物临床试验质量管理规范》。即使在应急的情况下,在整个评审过程中对疫苗安全性、有效性的评价标准也不能降低。
其他技术路线疫苗研究进展如何?
疫情发生之初,我国科研攻关组布局了病毒的灭活疫苗、核酸疫苗、重组蛋白疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗五条技术路线。除了腺病毒载体疫苗和灭活疫苗之外,其他几条技术路线的疫苗也在加快推进。
吴远彬介绍,减毒流感病毒载体疫苗已完成疫苗毒株的构建和质检方法的建立,正在进行质量工艺研究和质量鉴定,中试生产、动物攻毒实验和安全性评价实验也在同期开展。重组蛋白疫苗已完成毒种的构建,正在开展细胞和毒种鉴定、遗传稳定性考察、动物攻毒实验和安全性评价实验。核酸疫苗进入动物有效性和安全性评价研究阶段,并同步开展临床样品的制备和质量的检定工作。
■ 现场
84岁志愿者曾是一名军人